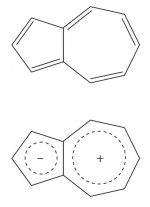
Азулен
Азуле́н (від ісп. azul — блакитний) — небензоїдна ароматична речовина (брутто-формула C10H8), структура якої може бути представлена як конденсовані п’яти- та семичленне кільця.
Формально число π-електронів у кожному з цих кілець окремо не відповідає правилу Гюккеля 4n + 2, але загальне число в обох кільцях відповідає й дорівнює 10. До того ж делокалізація електронів у кільцях дає полярну структуру з шістьма π-електронами в кожному кільці, що приводить до великого дипольного моменту (близько 1 Д; для порівняння: дипольний момент нафталіну — симетричного ізомеру азулену — дорівнює нулю). Полярність азулену є причиною його інтенсивного забарвлення: за нормальних умов азулен утворює сині пластинчасті кристали. Відносна молекулярна маса азулену 128,17; tпл. = 99 °C; tкип. = 242 °C; нерозчинний у воді, розчинний у вуглеводнях, діетиловому етері, спиртах. Унікальна особливість азулену: для нього не виконується правило Каші: флюоресценція відбувається з S2 стану (λfl = 374 нм), що робить його важливою модельною системою для дослідження фотофізичних процесів. Як барвник азулен відомий з 15 ст., але виділений як індивідуальна речовина лише в середині 19 ст., а його структуру встановлено тільки в 1930-ті. У природі азулен трапляється в складі деяких рослин, грибів та морських безхребетних, але зручнішим є синтетичний спосіб його добування. Легко (легше від бензену) вступає в реакції електрофільного заміщення по п’ятичленному кільцю. Надзвичайно легко приєднує протон; окиснюється на повітрі та перманганатом калію; ізомеризується в нафтален. Азулен і його природні похідні широко використовують у парфумерії та косметиці.
Література
- Berlman I. B. Handbook of fluorescence spectra of aromatic molecules. New York, London, 1971.
- Михеев Ю. А., Гусева Л. Н., Ершов Ю. А. Природа ароматичности азулена и его димеров, ответственных за цветность // Журнал физической химии. 2012. Т. 86. № 12.