Атомний спектр
А́томний спектр — оптичний спектр, що утворюється під час випромінювання атомами гамма-квантів.
Історична довідка
Вперше атомні спектри було відкрито 1802 фізиком та хіміком В. Волластоном (1766–1828, Велика Британія) і досліджено 1814 фізиком Й. Фраунгофером під час спектрометричних спостережень сонячного світла. Згодом Фраунгофер склав каталог, у якому описав 574 лінії, що отримали назву «фраунгоферові». Г. Кірхгоф та Р. Бунзен (1811–1899, Німеччина) у працях з дослідження спектру полум’я парів металевих солей довели: ідентифіковані лінії спектру характеризують хімічні елементи, що їх випромінюють.
Характеристика
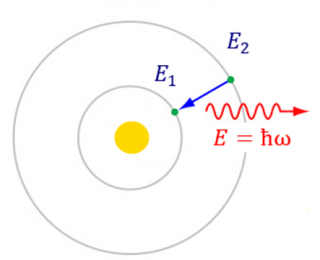
Атомний спектр спостерігають у розріджених газах, у парі та в плазмі. На відміну від неперервного спектру електромагнітного випромінювання нагрітого твердого тіла, атомний спектр є дискретним. Дискретність зумовлена переходом атомів із стану з більшою енергією [math]E_2[/math] до стану з меншою енергією [math]E_1[/math] (рис. 1).
Енергію гамма кванта обчислюють за такою формулою: [math]E = ħω =ħ 2πс/λ = E_2 - E_1[/math], де [math]ħ[/math] — зведена Планка стала, [math]ω[/math] — частота гамма-кванта, [math]с[/math] — швидкість світла, [math]λ[/math] — довжина хвилі гамма кванта.
Атомні спектри є лінійчастими, тобто складаються з окремих спектральних ліній, кожна з яких відповідає переходу між двома електронними рівнями енергії атома [math]Е_і[/math] та [math]Е_k[/math] і характеризується значенням частоти [math]ν[/math] електромагнітного випромінювання, що поглинається й випромінюється: [math]hν = Е_і — Е_k[/math]. Окрім частоти [math]ν[/math] [с–1], спектральна лінія характеризується хвильовим числом [math]ν/с[/math] [см–1], де [math]с[/math] — швидкість світла, і довжиною хвилі [math]λ = с/ν[/math] [нм або мкм]. У випадку хімічного елемента Na спостерігаються спектральні лінії нейтрального атома (поряд із символом хімічного елемента лінії ставлять цифру І, наприклад NaІ для Na) та спектральні лінії йонізованого атома (поряд із символом хімічного елемента лінії ставлять цифри ІІ, ІІІ …, наприклад, NaІІ, NaІІІ … для Na+, Na++…).
Спектральну лінію позначають довжиною хвилі гамма кванта, що їй належить. Вимірюють довжину хвилі у ангстремах (1 Å= 10-10м).
Спектральні лінії об’єднуються у спектральні серії. Найпростіший за будовою атом водню (рис. 2) має кілька серій, у яких положення ліній визначають формулою Бальмера, виведеною в 1885:
[math]λ = h m^2 / (m^2 — n^2)[/math]
У випадку значень [math]n = 2, m = 3, 4, 5, 6[/math] та [math]h = 3.6456·10^−[/math]7 м (стала Бальмера) формула давала змогу точно визначити довжину хвиль.
В атомних спектрах багатоелектронних атомів, наприклад заліза (рис. 3), лінії теж можна згрупувати в серії, але зі складнішою закономірністю, ніж формула Бальмера.
Збудження атомних оболонок виникає під час нагріванні газу або під час електричного розряду. В першому випадку причиною збудження атомів є зіткнення їх з іншими атомами, в другому — з електронами. Теорія атомних спектрів є основою спектрального аналізу. Наявність електронних оболонок у атомів, а відповідно й дискретність атомних спектрів, що виникає під час переходу атомів із більш збудженого стану до менш збудженого, описано Е. Шредінгером 1926 у вигляді рівняння Шредінгера для частинки в кулонівському потенціалі, яке відтворює енергетичний спектр атома водню.
Висновки Шредінгера заклали основу нерелятивістської квантової механіки, яка доводить хвильову природу елементарних частинок.
Значення
Атомні спектри охоплюють широкий діапазон енергій від інфрачервоного до ультрафіолетового. Їх використовують у атомно-абсорбційній і атомно-емісійній спектрометрії, а також в астрономічних дослідженнях для визначення хімічного складу зір, галактик, туманностей та інших об’єктів.
Література
- Kirchhoff G., Bunsen R. Chemical Analysis by Observation of Spectra // Annalen der Physik und der Chemie (Poggendorff). 1860. Vol. 110. P. 161–189.
- Burdge J. Chemistry. 4th ed. New York : McGraw-Hill Education, 2016. 1200 p.
Автор ВУЕ

Оприлюднено: 01.08.2022
Важливо!
Ворог не зупиняється у гібридній війні і постійно атакує наш інформаційний простір фейками.
Ми закликаємо послуговуватися інформацією лише з офіційних сторінок органів влади.
Збережіть собі офіційні сторінки Національної поліції України та обласних управлінь поліції, аби оперативно отримувати правдиву інформацію.
Отримуйте інформацію тільки з офіційних сайтів

Офіс Президента України

Верховна Рада України

Кабінет Міністрів України

Служба безпеки України

Міністерство оборони України

Міністерство внутрішніх справ України

Генеральний штаб Збройних сил України

Державна прикордонна служба України

Кіберполіція