Ацетон
Ацето́н (від лат. acetum — оцет) — летка безбарвна легкозаймиста рідина з характерним запахом; найпростіший кетон СН3СОСН3. Інші назви: пропанон, диметилкетон.
Зміст
Характеристика
Фізичні властивості
Молярна маса 58,08 г/моль; температура кипіння — 56,29°С за 101,3 кПа, температура плавлення — 94,6°С, 1,3588, 0,791.
Змішується в будь-яких пропорціях із водою та більшістю органічних розчинників, наприклад ефіром, метанолом, етанолом, естерами.
Хімічні властивості
Ацетон виявляє хімічні властивості, характерні для аліфатичних кетонів, вступає в реакції нуклеофільного приєднання та конденсації за участі як карбонільної, так і метильної груп.
Характерні реакції
Ацетон окиснюється сильними окисниками (лужним розчином Калій перманганату, хромовою кислотою, гарячою нітратною кислотою) з утворенням ацетатної та форміатної кислот і далі Карбон(IV) оксиду і води. Гіпогалогеніди металічних елементів або галогени в лужному середовищі окиснюють ацетон до ацетату металічного елементу і галоформу. Під дією хлору і лугу утворює хлороформ CHCl3, який взаємодіє з ацетоном із утворенням хлоретону (СН3)2С(ОН)ССl3, що застосовується як антисептик. Галогенування ацетону каталізується як кислотами, так і основами, причому швидкість галогенування за наявності основи вища, ніж у кислому середовищі. За умов кислотного каталізу можна отримати моногалогенопохідні ацетону:
Ацетон відновлюється до пропан-2-олу (ізопропілового спирту) та пропану. Під час відновлення амальгамою магнію або цинку, а також цинком в оцтовій кислоті утворюється пінакон:

Відновний амоноліз приводить до ізопропіламіну.
Ацетон окиснює вторинні спирти до кетонів за наявності Алюміній алкоголятів (реакція Р. Оппенауера):
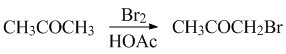
Сполуки з активним Гідрогеном приєднуються до карбонільної групи ацетону. Зі спиртами ацетон утворює кеталі (CH3)2C(OR)2, які також називають ацеталями. Утворення кеталів ацетону — п’ятичленних 1,3-діоксоланів та шестичленних 1,3-діоксанів — застосовується для захисту гідроксигруп в 1,2- і 1,3-діолах, особливо в хімії вуглеводів. Рівновага може бути зміщена у бік утворення кеталів, наприклад, зв’язуванням води безводним Купрум(II) сульфатом або її відгонкою в присутності пара-толуенсульфокислоти. Замість ацетону як захисні групи використовують 2,2-диметоксипропан (диметилацеталь ацетону) та 2-метоксипроп-1-ен. 2,2-диметоксипропан одержували в промисловості реакцією ацетону з метанолом за наявності кислоти та низької температури.
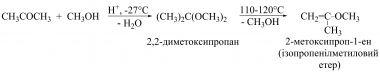
Завдяки тому, що 2,2-диметоксипропан легко гідролізує до метанолу і ацетону, його використовують як дегідратуючий агент.
Тіоли утворюють з ацетоном напівтіокеталі і тіокеталі (CH3)2C(SR)2. Із Гідроген сульфідом утворюється гексаметил-1,3,5-тритіан, ймовірно, через проміжне утворення тіоацетону, який легко тримеризується.
Під час взаємодії з ціанідною кислотою в лужному середовищі утворюється ацетонціаногідрин (CH3)2C(OH)CN. Ця реакція є основою одного з промислових методів одержання метилметакрилату:
Ацетонціаногідрин отримують також з ацетону та Натрій або Калій ціаніду за наявності сульфатної кислоти. Ацетон утворює кристалічну сіль з Натрій гідроген сульфітом (CH3)2C(OH)SO3Na, яку обробкою Натрій або Калій ціанідом можна перетворити на ацетонціаногідрин.
За наявності амоніаку Гідроген ціанід взаємодіє з ацетоном з утворенням 2-аміно-2-метилпропаннітрилу (CH3)2C(NH2)CN, з якого одержують ініціатор радикальної полімеризації азо-біс-ізобутиронітрил (СH3)2C(CN)N=NC(CN)(CH3)2.
Ацетон приєднує реагенти В. Гріньяра з утворенням третинних спиртів.
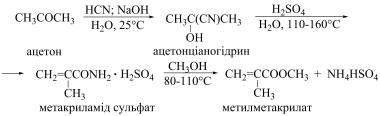
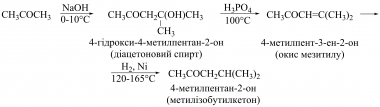
Ацетон вступає в альдольну конденсацію з утворенням діацетонового спирту (4-гідрокси-4-метилпентан-2-ону (СН3)2С(ОН)СН2СОСН3), далі у кротонову конденсацію з утворенням окису мезитилу (4-метилпент-3-ен-2-ону (СН3)2С=СНСОСН3), ізофорону (3,5,5-триметилциклогекс-2-ен-1-ону), форону (2,6-диметилгепта-2,5-дієн-4-ону (СН3)2С=СНСОСН=С(СН3)2) та мезитилену (1,3,5-триметилбензену). Із цих сполук виробляють промислові розчинники метилізобутилкетон (4-метилпентан-2-он), метилізобутилкарбінол (4-метилпентан-2-ол), гексиленгліколь (2-метилпентан-2,4-діол), діізобутилкетон, діізобутилкарбінол. Метилізобутилкетон, який використовують як розчинник, здебільшого у процесах покриття поверхонь лаками, фарбами, полімерними плівками тощо, одержують за схемою:
Ацетон вступає у конденсацію Р. Клайзена з етилацетатом з утворенням ацетилацетону (пентан-2,4-діону), реакцію К. Манніха з формальдегідом та вторинними амінами — α-діалкіламінометилзаміщених ацетонів. За реакцією С. Реформатського утворюються β-гідроксиестери. Конденсацією ацетону з хлорооцтовими естерами за наявності Натрій етаноляту одержують α,β-епоксиестери (гліцидні естери) (конденсація О. Дарзана).
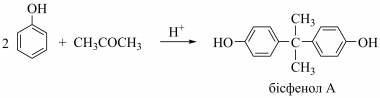
Фенол реагує з ацетоном у кислому середовищі з утворенням так званого біс- фенолу A (4,4’-(пропан-2,2-діїл)дифенілу), що використовується у виробництві полікарбонату та епоксидних смол.
Ацетон конденсується з похідними амоніаку за наявності кислотного каталізатора. З первинними амінами утворюються іміни — основи Шиффа (CH3)2C=NR, із вторинними амінами — енаміни. З гідроксиламіном утворюється оксим (CH3)2C=NOH, із гідразином та його похідними — відповідні гідразони (CH3)2C=NNHR. Кристалічні похідні ацетону, наприклад 2,4-динітрофенілгідразон (температура плавлення — 126–128°С) або семикарбазон (температура плавлення — 187°С), використовують для його ідентифікації.
Під час піролізу ацетону (700°С) утворюються кетен СН2=С=О і метан. Ця реакція застосовується у промисловому виробництві кетену.
Шляхи отримання
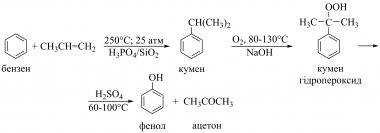
У промисловості близько 90 % ацетону виробляють разом із фенолом за кумен-гідропероксидним способом — кислотно-каталізованим розкладанням кумен гідропероксиду. Його одержують окисненням киснем повітря ізопропілбензену (кумен, застаріла назва кумол), який отримують з бензену та пропену. На кожну тонну фенолу утворюється до 0,62 тонни ацетону, вихід якого сягає 94 %.
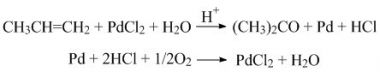
Ацетон також одержують гідратацією пропену до пропан-2-олу (ізопропілового спирту) з його подальшим окисненням над металічним срібним каталізатором (450–500°С) або дегідруванням за наявності каталізаторів на основі цинку (400°С). Ацетон також отримують прямим окисненням пропену в рідкій фазі за наявності Паладій(II) хлориду.
Давній промисловий метод одержання ацетону — суха перегонка Кальцій ацетату — втратив своє значення.
Для якісного визначення ацетону використовують кольорові реакції.
- Поява червоно-фіолетового забарвлення під час взаємодії зі спиртовим розчином 1,3-динітробензену за наявності лугу.
- Йодоформна реакція — взаємодія з йодом у лужному середовищі з утворенням жовтого осаду йодоформу CHI3, речовини зі специфічним запахом.
- Поява інтенсивного червоного забарвлення з нітропрусидом натрію Na2[Fe(CN)5NO] (реактив Легаля) в лужному середовищі, яке у випадку підкислення ацетатною кислотою переходить у червоно-фіолетове.
- Утворення червоної забарвленої сполуки в результаті реакції з фурфуролом.
- Утворення індиго, що має синій колір, під час взаємодії з о-нітробензальдегідом у лужному середовищі.
Кількісно ацетон визначають титруванням розчином Калій перманганату у лужному середовищі, який окиснює ацетон до СО2 і Н2О; оксимуванням із подальшим титруванням лугом Гідроген хлориду, що утворився:
Значення та використання
Ацетон — важливий розчинник, який застосовують у промисловості та лабораторній практиці. Його використовують у виробництві штучних волокон, вибухових речовин; як розчинник для вінілових та акрилових смол, ацетил та нітроцелюлозних лаків, алкідних фарб, чорнил, лікарських засобів та косметики. Завдяки порівняно малій токсичності його застосовують також у харчовій промисловості. Ацетон є вихідною речовиною для синтезу кетену, оцтового ангідриду, діацетонового спирту, окису мезитилу, метилізобутилкетону, метилметакрилату та ін.
Ацетон — продукт метаболізму в організмі людей та деяких інших ссавців і входить до складу їхньої крові та сечі. У хворих на цукровий діабет він присутній у відносно великих кількостях.
Ацетон є легкозаймистою речовиною. Температура спалаху -20°С, температура самозаймання 500°С. Вибухонебезпечні суміші з повітрям, що містять 1,6–15,3 об. % ацетону. Під час вдихання ацетон накопичується в організмі. Оскільки він повільно виводиться з організму, можливі хронічні отруєння ГДК 200 мг/м3.
Література
- Терней А. Современная органическая химия : в 2 т. Москва : Мир, 1981.
- Kirk-Othmer Encyclopedia of Chemical Technology : in 27 vol. 5th ed. New York; Chichester : Wiley, 2004. Vol. 1. 872 p.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. 3-тє вид. Львів : Центр Європи, 2009. 868 с.
- Acetone: Biochemistry, Production and Uses / Ed. by I. Kozlowska, Kl. Walczak. New York : Nova Science Publishers, 2018. 208 p.
Автор ВУЕ

Покликання на цю статтю: Гордієнко О. В. Ацетон // Велика українська енциклопедія. URL: https://vue.gov.ua/Ацетон (дата звернення: 5.05.2024).

Статус гасла: Оприлюднено
Оприлюднено: 21.02.2021
Важливо!
Ворог не зупиняється у гібридній війні і постійно атакує наш інформаційний простір фейками.
Ми закликаємо послуговуватися інформацією лише з офіційних сторінок органів влади.
Збережіть собі офіційні сторінки Національної поліції України та обласних управлінь поліції, аби оперативно отримувати правдиву інформацію.
Отримуйте інформацію тільки з офіційних сайтів

Офіс Президента України

Верховна Рада України

Кабінет Міністрів України

Служба безпеки України

Міністерство оборони України

Міністерство внутрішніх справ України

Генеральний штаб Збройних сил України

Державна прикордонна служба України

Кіберполіція
