Ацетилен
Ацетиле́н (від лат. лат. acetum ― оцет і грец. ὔλη― речовина, сировина), етин CH≡CH ― найпростіший вуглеводень із потрійним зв’язком.
Зміст
Історія відкриття
Ацетилен відкрив 1836 хімік Е. Деві (Велика Британія). Уперше синтезував 1862 М. Бертло з вугілля та водню. Утворення ацетилену у вольтовій дузі між вугільними електродами в атмосфері водню стало першим синтезом найпростішого вуглеводню.
Будова молекули
Атоми Карбону (вуглецю) в ацетилені sp-гібридизовані. Вони сполучені одним σ-зв’язком, що утворився внаслідок перекривання двох еквівалентних sp-гібридних орбіталей, і двома π-зв’язками, утвореними внаслідок перекривання двох pz і py орбіталей. Електронна густина у двох ортогональних π-зв’язках утворює тор із циліндричною віссю симетрії.
Ацетилен має лінійну будову; довжина зв’язків –С≡С– і ≡С–Н становить, відповідно, 0,118 і 0,108 нм, енергія зв’язку С≡С ― 837 кДж/моль, енергія зв’язку С–Н ―506 кДж/моль:
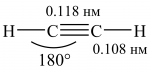
Фізичні властивості
Безбарвний газ; молекулярна маса — 26,0379; температура плавлення — –81 °С за 170,3 кПа; температура кипіння —–83,8 °С.; густина—1,095 кг/м3 (газ; 20 °С; 101 кПа); ентальпія утворення —227,5±1,0 кДж/моль (газ; 298,15 К), ентальпія згоряння — 1307 кДж/моль; критична точка — 35,2°С, критичний тиск — 6,4 МПа; потрійна точка —–80,75°С; тиск пари — 2,6633 МПа (273,15 К).
Розчинність (об’єм ацетилену) в 1 обє’мі розчинника за 15 °С і 101 кПа: у воді ―1,15; в ацетоні ―25 (за 1,2 Мпа ―300); у спирті ―6; у бензені ―4; в етановій (оцтовій) кислоті ― 6 (за 18 °С); диметилформаміді ― 33,5 (25 °С).
Хімічні властивості
Ацетилен є слабкою C–H кислотою з pKa ~ 25, тому під дією сильних основ можливе заміщення атомів Гідрогену (водню) на атоми металічного елемента з утворенням ацетиленідів. Ці сполуки енергійно реагують з водою із виділенням ацетилену.
Ацетиленіди деяких металічних елементів можна добути реакцією тонкоподрібненого металу з ацетиленом в інертних розчинниках (ксилен, діоксан, тетрагідрофуран) за 38–45 °C.
Ацетиленіди лужних і лужноземельних елементів утворюються внаслідок реакції ацетилену з відповідним амідом у безводному рідкому амоніаку:
Літій ацетиленід з етилендіаміном утворює міцний комплекс HC≡CLi NH2CH2CH2NH2.
Утворення червоного осаду Сu2С2 або сірувато-білого осаду Ag2C2 внаслідок дії на ацетилен розчинів аміакат і водновалентних Купруму (міді) та Аргентуму (срібла) можна використовувати для визначення ацетилену:
Ацетиленіди Купруму, Aргентуму, Меркурію (ртуті), Ауруму (золота) вибухонебезпечні.
Взаємодією ацетилену з магнійорганічними сполуками добувають як моно-, так і дизаміщені ацетиленідмагнійгалогеніди. Реакцію зазвичай проводять у середовищі діетилового етеру (ефіру) або тетрагідрофурану (ТГФ) з використанням етилмагнійброміду C2H5MgBr:
Алкілюванням ацетиленідів металічних елементів первинними алкілгалогенідами, алкілсульфатами або алкілсульфонатами добувають гомологи ацетилену. Послідовно можна ввести дві різні групи:
Для ацетилену характерні реакції приєднання. Гідрування ацетилену до етену та етану відбувається за участі каталізаторів ― платини, паладію, нікелю. Селективне гідрування ацетилену над нікелевим та паладієвим (каталізатор Ліндлара, H. Lindlar) каталізаторами має велике значення для промислового виробництва етену.
Приєднання галогенів за потрійним зв’язком відбувається за схемою:
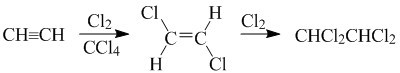 .
.Ферум (III) хлорид (хлорид заліза (ІІІ) FeCl3) каталізує приєднання хлору до ацетилену з утворенням 1,1,2,2-тетрахлороетану, який використовують у виробництві промислових розчинників ―1,2-дихлороетену (1,2-дихлоретилену), трихлороетену (трихлоретилену) та тетрахлороетену (перхлоретилену).
Ацетилен може бути прямо хлорований до транс-1,2-дихлороетену із застосуванням ферум (ІІІ) хлориду як каталізатора і за великого надлишку ацетилену. Транс-1,2-Дихлороетен добувають з ацетилену в розчинах із використанням хлоридів Купруму (І) і Купруму (ІІ) та хлоридної (хлороводневої) кислоти.
Бром у розчині або в рідкому стані приєднується до ацетилену з утворенням спочатку транс-1,2-дибромоетену, а потім ― тетрабромоетану. Йод приєднується важче, а реакція зупиняється на стадії утворення 1,2-дійодоетену.
Ацетилен приєднує гідрогенгалогеніди з утворенням вінілгалогенідів. Гідрохлорування ацетилену (каталізатори ― купрум (І) хлорид і меркурій (ІІ) хлорид) є одним із промислових способів добування вінілхлориду ― вихідної речовини у виробництві полівінілхлориду (ПВХ):
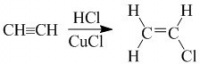 .
.Гідратація ацетилену (приєднання води) відбувається в кислому середовищі під дією солей Mеркурію (І) з утворенням ацетальдегіду (реакція М. Кучерова):
.
Гідратацію можна здійснити також пропусканням суміші ацетилену з водяною парою за 300–400 °С над фосфатами важких металічних елементів. У промисловості гідратацію ацетилену використовують для виробництва ацетальдегіду (етаналю) і продуктів дальших його перетворень ― етанової (оцтової) кислоти, ацетону, етанолу.
У процесі вінілювання ацетилен приєднує спирти, феноли, тіоли, вторинні аміни, карбонові кислоти, аміди, синильну кислоту тощо з утворенням відповідних вінілових похідних. Ці реакції застосовують у промисловості для виробництва полімерних речовин, емульгаторів тощо. Вінілацетат добувають у газовій фазі за 180–200 °C із солями Кадмію, Цинку, Меркурію як каталізаторами:
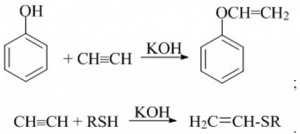
Ацетилен приєднує ціанідну (синильну) кислоту з утворення макрилонітрилу в рідкій (каталізатор купрум (І) хлорид, кисле середовище) або газовій (основний каталізатор, 400–600 °C) фазі. Деякий час це був основний комерційний спосіб добування акрилонітрилу:
Під час етинілювання відбувається приєднання альдегідів і кетонів доацетилену з утворенням ацетиленових спиртів (реакція О. Фаворського):
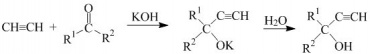 .
.Добування натрієвої солі ацетилену та її приєднання до карбонільної групи альдегідів і кетонів проводятьз натрій амідому рідкому амоніаку. В. Реппе розробив промисловий спосіб приєднання ацетилену до формальдегіду на основі реакції О. Фаворського. Реакцію проводять за високого тиску (~100 атм) заучасті купрум(I) ацетиленіду. Це дає змогудобути пропаргіловий спирт та бут-2-ин-1,4-діол:
Бутиндіол є вихідною речовиною для синтезу важливого промислового продукту його гідрування ―бутан-1,4-діолу. Карбонілювання ― це реакція ацетилену з карбон (II) оксидом за участі каталізатора Ni(CO)4 зі сполуками з рухливим атомом Гідрогену: водою, спиртами, тіолами, амінами. Продукти цих реакцій ― похідні акрилової кислоти, наприклад, естери або аміди, застосовують у синтезі полімерів:
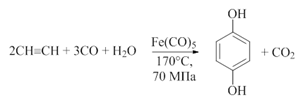 .
.Полімеризацію ацетилену (олігомеризацію довінілацетилену та дивінілацетилену) каталізують солі Купруму (I) у хлоридній кислоті. Над активованим вугіллям ацетилен тримеризується в бензен. Циклотетрамеризація ацетилену в циклоокта-1,3,5,7-тетраєн відбувається за участі комплексів двовалентного Нікелю (реакція В. Реппе):
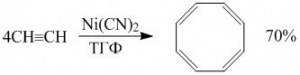 .
.У випадку застосування каталізатора Ni(CO)2[(C6H5)3P]2 продуктами циклізації ацетилену є бензен (~ 88 %) та стирен (~ 12 %). Реакцію проводять у бензені за 65–75 °C і тиску 1,5МПа. Для добування поліацетилену –(CH=CH)n– використовують каталізатори Циглера ― Натта за тиску 10-2–1 МПа.
Добування
Основні промислові способи добування ацетилену такі:
1) термоокисний крекінг (часткове окиснення) природного газу з використанням тепла, що виділяється внаслідок часткового згоряння метану(СН4 : О2 = 1 : 0,65):
2) електрокрекінг природного газу (метану з домішками гомологів) в електродугових печах: метан пропускають між металевими електродами за нормального тиску і 1600 °С, час контакту0,1–0,01 с; суміш газів, що утворилася, різко охолоджують водою. Добутий газ містить 12–15 % за об’ємом ацетилену (теоретично можливо 25 %), який виділяють розчиненням у воді під тиском. Процес добування ацетилену електрокрекінгом описує рівняння:
3) піроліз природного газу;
4) розкладання кальцій карбіду водою (карбідний метод); його застосовують у лабораторних умовах і в промисловості:
Недоліком карбідного методу є великі енерговитрати під час добування кальцій карбіду, добутий з нього ацетилен містить домішки, основними з яких є фосфін, амоніак, сульфіди, що надають йому специфічного запаху.
Безпека
Ацетилен утворює з повітрям і киснем вибухові суміші. У стиснутому й, особливо, зрідженому стані він здатний вибухати від удару. Ацетилен вибухає за температури ~ 500°С або тиску > 0,2 МПа; температура його самозаймання становить 335 °С.
Вибухонебезпечність зменшується внаслідок розведення ацетилену іншими газами, наприклад, азотом, метаном або пропаном. Ацетилен зберігають і транспортують у сталевих балонах, заповнених інертною поруватою масою (наприклад, деревним вугіллям), у вигляді розчинів в ацетоні під тиском 1,5–2,5 МПа. Ацетилен виявляє слабку токсичну дію; ГДК 0,3 мг/м3.
Значення
Ацетилен має важливе значення у промисловості. Під час згоряння (повного окиснення) ацетилену виділяється велика кількість тепла, на чому базується ацетилено-кисневе зварювання й різання чорних металів. Через простоту добування, відносно низьку вартість та хімічну активність ацетилен використовують як вихідну речовину для багатьох хімічних синтезів: етаналю, етанової кислоти, етену та його хлорованих похідних, тетрахлороетану, вінілхлориду, хлоропрену ― мономера для хлоропренового каучуку, вінілацетату ― для подальшого виробництва полівінілацетату (ПВА, основи для клеїв, водоемульсійних та акрилових фарб), бутадієнового каучуку тощо.
Література
- Вацуро К. В., Мищенко Г. Л. Именные реакции в органической химии. Москва : Химия, 1976. 528 с.
- Терней А. Современная органическая химия. Москва : Мир, 1981. 678 с.
- Химическая энциклопедия: в 5 т. Москва : Сов. энцикл., 1988. Т. 1: А–Дарзана / Редкол.: Кнунянц И. Л. и др. 623 с.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия: в 4 ч. Москва : Бином; Лаборатория знаний, 2004.
- Лозинський М. О. Ковтуненко В. О. Карбаніони. Добування та алкілування. Київ : Трео-Плюс, 2008. 626 с.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. Львів : Центр Європи, 2009. 868 с.
- Pässler P., Hefner W., Buckl K., Meinass H., Meiswinkel A., Wernicke H.-J., Ebersberg G., Müller R., Bässler J., Behringer H., Mayer D. Acetylene // Ullmann's Encyclopedia of Industrial Chemistry.Weinheim : Wiley-VCH, 2012.Vol. 1.
Автори ВУЕ

Покликання на цю статтю: Гордієнко О. В., Любчук Т. В. Ацетилен // Велика українська енциклопедія. URL: https://vue.gov.ua/Ацетилен (дата звернення: 5.05.2024).

