Алкени
Алке́ни (від араб. الكحل — дуже дрібний порошок, сурма; або від الكحول — спирт; або від الغ чи الغول — дух, демон), олефіни, етиленові вуглеводні — ациклічні розгалужені або нерозгалужені вуглеводні з одним подвійним зв’язком між атомами Карбону.
Зміст
Гомологічний ряд
Загальна формула вуглеводнів гомологічного ряду алкенів CnH2n. Вуглеводні з більшою кількістю подвійних зв’язків називають алкадієнами, алкатриєнами тощо. Подвійні зв’язки можуть бути ізольованими або кон’югованими (чергування простих і подвійних зв’язків).
Будова молекул
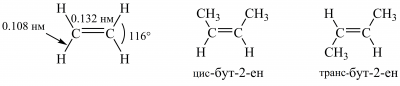
Атоми Карбону біля подвійного зв’язку перебувають у стані sp2-гібридизації та утворюють σ- і π-зв’язки. σ-Зв’язки в алкенах виникають за рахунок перекривання двох sp2-гібридизованих орбіталей кожного з атомів Карбону й розташовані в одній площині під кутами, близькими до 120°. Унаслідок перекривання двох pz-орбіталей виникає π-зв’язок. Найпростіший алкен ― етен C2H4 ― має площинну будову. У заміщених алкенах валентні кути С-С-С збільшуються через відштовхування атомів Карбону, наприклад у транс-бут-2-ені кут С-С-С становить 124°. Довжина подвійного зв’язку (0,132 нм) менша порівняно з довжиною ординарного зв’язку в алканах:
Ізомерія
Для алкенів (від бутенів і далі), нарівні з ізомерією карбонового скелета і за місцем подвійного зв’язку, можлива геометрична цис-транс-ізомерія, зумовлена високим бар’єром обертання навколо подвійного зв’язку (~ 270 кДж/моль для 1,2-дидейтероетену). Так, бут-2-ен існує у вигляді двох конфігураційних ізомерів: цис-бут-2-ену і транс-бут-2-ену. Транс-алкени термодинамічно стійкіші, ніж їхні цис-ізомери. Стабільність алкенів послідовно зменшується від тетразаміщених алкенів до етену.
Номенклатура
Тривіальні назви перших членів гомологічного ряду алкенів утворюють від назв алканів заміною суфікса -ан на -илен(-ілен): етилен СH2=CH2, пропілен CH3CH=CH2, ізобутилен (CH3)2C=CH2. Залишок CH2=CH– називають вінільним, CH2=CH–CH2– ― алільним. За систематичною номенклатурою назви алкенів утворюють від назв відповідних алканів заміною суфікса -ан на -ен. Щоб назвати алкен, вибирають найдовший ланцюг, що містить подвійний зв’язок. Нумерацію атомів починають з того кінця, до якого подвійний зв’язок розташований ближче. Цифру, що вказує атом Карбону, після якого розташований подвійний зв’язок, позначають перед суфіксом -ен. Префікси цис- і транс- зазначають на початку назви.
Якщо біля подвійного зв’язку є три або чотири різні замісники, застосовують універсальну Z,E-номенклатуру: позначення Z і E вибирають за просторовим розташуванням двох найстарших за R,S-системою груп. Якщо обидва найстарші замісники розташовані по один бік подвійного зв’язку, сполука має Z-конфігурацію, якщо по різні боки ― E-конфігурацію:
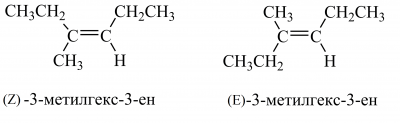
Фізичні властивості
За температури 20–25 °C і атмосферного тиску етен, пропен і бутени ― гази, алкени від С5 до С18 ― безбарвні рідини, вищі алкени ― тверді речовини. Алкени майже не розчиняються у воді, обмежено ― у спиртах і добре ― у вуглеводнях, їхніх галогенопохідних, етерах та естерах. Етен і пропен мають слабкий запах. За збільшення кількості атомів Карбону та розгалуженні ланцюга запах стає їдким, подразнює слизові оболонки.
Хімічні властивості
Алкени виявляють високу реакційну здатність. Для них характерні реакції за участю подвійного зв’язку. Гідрування алкенів відбувається тільки за наявності гетерогенних (платини, паладію, рутенію, родію, осмію і ніобію або сполук відповідних хімічних елементів) або гомогенних каталізаторів, зокрема каталізатора Уїлкінсона (Sir Geoffrey Wilkinson) ― [(C6H5)3P]3RhCl, [(C6H5)3P]3RuClH тощо:
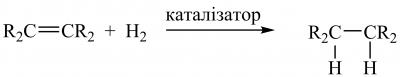
Найхарактернішими для алкенів є реакції електрофільного приєднання за місцем подвійного зв’язку галогенів, гідроген галогенідів, води, спиртів, фенолів, кислот, амінів, тіолів тощо. Приєднання галогенів (хлору, брому, йоду ―важче) відбувається з утворенням 1,2-дигалогеноалканів. Гідрогалогенування ― приєднання гідроген галогенідів HCl, HBr, HI, HF проходить у газовій фазі або в розчинах. У несиметричних алкенів приєднання відбувається згідно з правилом В. Марковникова: Гідроген приєднується до найменш заміщеного атома Карбону:
Каталізована кислотами гідратація алкенів з утворенням спиртів також проходить за правилом В. Марковнікова:
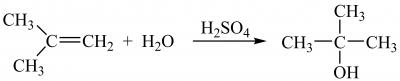
Гідратація алкенів легко відбувається внаслідок оксимеркурування меркурій(II) етаноатом (ацетатом) та подальшим обробленням натрій борогідридом:
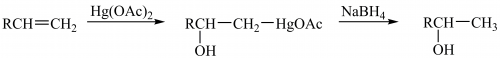
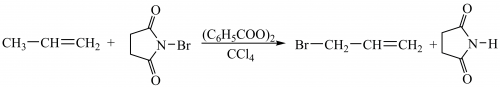
За умов, що сприяють гомолітичному розриву зв’язків (висока температура, опромінення, наявність кисню або пероксидів), приєднання до алкенів відбувається за радикальним механізмом проти правила В. Марковникова. За таких умов проходять реакції радикального заміщення в алільному положенні алкенів: хлорування пропену за температури 300 °С з утворенням алілхлориду CH2=CHCH2Cl, бромування алкенів за допомогою N-бромосукциніміду за опромінення або за наявності пероксидів у тетрахлорометані (реакція А. Воля ― К. Циглера):
Гідроборування алкенів ― приєднання гідридів Бору за подвійним зв’язком ― проходить з утворенням триалкілборанів, які під дією етанової (оцтової) кислоти перетворюються на алкани:
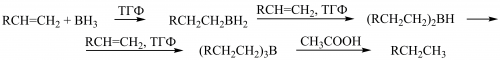
За участю подвійних зв’язків відбувається промислово важлива полімеризація алкенів ― етену, пропену, бутенів тощо:
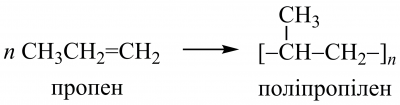
Реакції циклоприєднання (карбенів, дієновий синтез (реакція О. Дільса ― К. Альдера, Otto Diels, Kurt Alder), метатезису алкенів (обмін замісниками двох молекул алкенів за наявності каталізаторів на основі комплексних сполук Молібдену, Вольфраму, Рутенію) також проходять за участю подвійних зв’язків. Реакція метатезису етену з бут-2-еном ― один з промислових методів добування пропену:
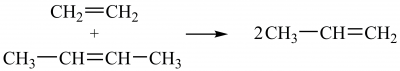
Олігомеризацією та метатезисом алкенів добувають лінійні альфа-олефіни, які використовують у виробництві полімерів, поверхнево-активних речовин тощо.
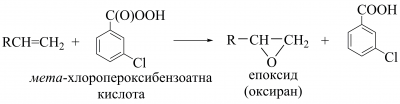
Окиснення алкенів проходить за місцем подвійного зв’язку з утворенням різних продуктів залежно від окисника та умов реакції. Епоксидування з утворенням епоксидів проходить під дією пероксикислот (реакція М. Прилежаєва), у сучасному варіанті ― мета-хлоропероксибензоатної кислоти в неполярному середовищі:
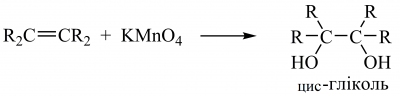
Гідроксилювання алкенів залежно від умов відбувається як син- або анти-приєднання та приводить до утворення 1,2-діолів (гліколів). Під дією водного розчину KMnO4 у слабколужному середовищі за 0–5 °C (реакція Є. Вагнера) або під дією осмій(VIII) оксиду за присутності гідроген пероксиду утворюються цис-гліколі:
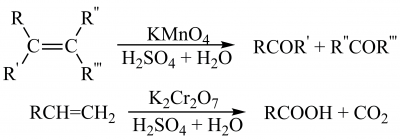
Розщеплення карбонового скелета алкенів за місцем подвійного зв’язку й утворення як кінцевих продуктів кетонів та/або карбонових кислот в залежності від замісників біля подвійного зв’язку відбувається під дією таких регентів, розчин калій перманганату у водній сульфатній кислоті; розчин хром(VI) оксиду в етановій кислоті, калій дихромату в сульфатній кислоті:
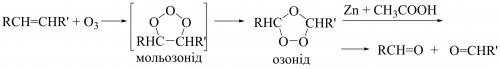
Озоноліз ― розщеплення алкенів за подвійним зв’язком ― проходить під час взаємодії з озоном з утворенням мольозоніду (1,2,3-триоксолану), який через нестабільність розкладається з утворенням нормального озоніду (1,2,4-триоксолану). Під час розкладання озонідів утворюються кетони та/або карбонові кислоти, а за відновлювальних умов (цинк в етановій (оцтовій) кислоті або диметилсульфід Me2S) ― кетони та/або альдегіди; у присутності натрій борогідриду ― первинні або вторинні спирти:
Гідроформілювання алкенів (оксосинтез) ― взаємодія алкенів з карбон(II) оксидом та воднем під тиском за наявності каталізаторів на основі сполук Кобальту є промислово важливим методом добування альдегідів (в окремих випадках ― кетонів):
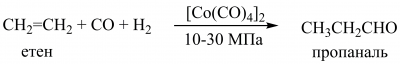
Алкени за наявності алюміній хлориду, бор трифлуориду, гідроген флуориду та інших кислотних каталізаторів застосовують для алкілювання насичених вуглеводнів, а також ароматичних сполук. У такий спосіб у промисловості добувають ізопропілбензен (кумен):
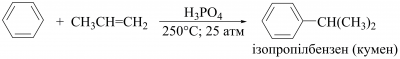
Каталізовані паладієм реакції сполучення алкенів з арил-, алкіл-, вінілгалогенідами дають змогу ввести вінільний фрагмент (реакція Р. Хека). Найліпше реакція проходить з етеном:
Алкени утворюють π-комплекси з катіонами перехідних елементів, що містять незаповнені орбіталі ― Ag+, Cu+, Pt2+, Pd2+, наприклад сіль В. Цейзе: K[PtCl3(CH2=CH2)].
Добування
Етен і пропен трапляються в природі. У промислових масштабах етен, пропен, бутени добувають піролізом та каталітичним крекінгом продуктів переробки нафти. Інші методи можна об’єднати у дві групи: уведення подвійного зв’язку в наявний карбоновий ланцюг та створення карбонового скелета водночас із подвійним зв’язком. До першої групи входять реакції 1,2-елімінування.
Дегідрогалогенування алкілгалогенідів під дією основ, наприклад, концентрованих розчинів лугів, алкоголятів, біциклічних амідинів ― діазабіциклононену (ДБН), діазабіциклоундецену (ДБУ). Воно переважно відбувається з утворенням найбільш заміщених алкенів (правило О. Зайцева):
Дегідрогалогенування алкілгалогенідів можна провести також термічно. Дегідратація спиртів за нагрівання та наявності кислот (сульфатної, ортофосфатної) або в паровій фазі над алюміній оксидом:
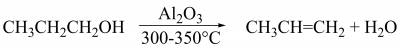
Елімінування від 1,2-дигалогеноалканів, найчастіше за участю цинку, магнію, натрій або калій йодидів:
Розщеплення N-оксидів третинних амінів (елімінування за А. Коупом):
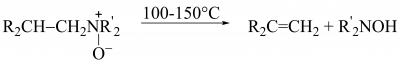
Елімінування третинних амінів з тетраалкіламоній гідроксидів з утворенням алкенів з кінцевим подвійним зв’язком (елімінування за А. Гофманом):
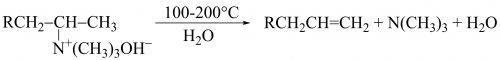
Алкени можна добути відновленням алкінів та дієнів за участі селективних каталізаторів. Гідрування над паладієм на кальцій карбонаті, дезактивованим плюмбум(II) етаноатом та хіноліном (каталізатор Ліндлара), паладієм на барій сульфаті, дезактивованим хіноліном (каталізатор К. Розенмунда) приводить до утворення цис-алкенів. Стереоспецифічне відновлення діалкілацетиленів до цис-алкенів проходить під дією діізобутилалюмінійгідриду (ДІБАЛ-H), тоді як натрій у рідкому амоніаку відновлює алкіни до транс-алкенів:
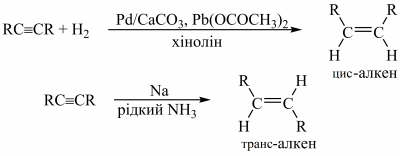
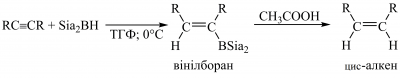
Гідроборування алкінів просторово утрудненими боранами (наприклад, дисіамілбораном [(CH3)2CHCH(CH3)]2BH (Sia2BH) або дициклогексилбораном) відбувається стереоспецифічно як син-приєднання, яке зупиняється на стадії утворення вінілборану. Реакцію використовують для добування цис-алкенів:
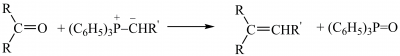
Загальним способом побудови карбонового скелету з подвійним зв’язком у визначеному місці є взаємодія альдегідів або кетонів з ілідами фосфору з утворенням алкенів та фосфіноксиду (реакція Г. Віттіга):
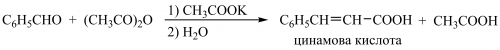
Іншим методом є конденсації карбонільних сполук зі сполуками з активною метиленовою групою, наприклад реакція В. Перкіна:
або реакція Е. Кньовенагеля:
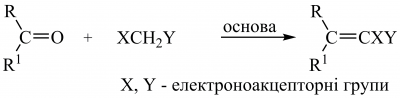
Увести вінільний фрагмент можна сполученням алкенілборанів з вініл-, алкініл-, бензил-, арилгалогенідами, каталізованим паладієм за наявності основи. Сполучення вінілгалогенідів з алкілборатними кислотами (реакція А. Сузукі), а алкенілстаннанів з алкеніл-, алкіл-, арилгалогенідами або трифлатами (реакція Дж. Стілла) дають змогу синтезувати заміщені алкени:
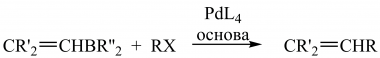 ;
;Значення
Алкени застосовують у хімічній промисловості як вихідні реагенти для добування полімерів (поліетилену, поліпропілену тощо), еластомерів, епоксисполук, дихлороетану, вінілхлориду, етанолу, ізопропанолу, етаноламінів, етаналю, етанової кислоти, діоксану, стирену, гліцеролу, кумену, акрилонітрилу, бутаналю, бута-1,3-дієну, бутанолів, каучуків, мастил, поверхнево-активних речовин тощо.
Література
- Общая органическая химия / Под ред. Д. Бартона, У. Д. Оллиса; пер. с англ. Москва : Химия, 1981. 736 с.
- Марч Дж. Органическая химия : в 4 т. / Пер. с англ. Москва : Мир, 1987–1988.
- Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. Москва : Советская энциклопедия, 1992. Т. 3. 640 с.
- Лозинський М. О. Ковтуненко В. О. Карбаніони. Добування та алкілування. Київ : Трео-Плюс, 2008. 626 c.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. 4-те вид. Львів : Центр Європи, 2009. 868 с.
- Геваза Ю. І., Гетьманчук Ю. П. Основи органічної хімії. Київ : Київський національний торговельно-економічний університет, 2013. 356 с.
Автор ВУЕ

Покликання на цю статтю: Гордієнко О. В., Любчук Т. В. Алкени // Велика українська енциклопедія. URL: https://vue.gov.ua/Алкени (дата звернення: 6.05.2024).

Оприлюднено: 11.10.2019
Важливо!
Ворог не зупиняється у гібридній війні і постійно атакує наш інформаційний простір фейками.
Ми закликаємо послуговуватися інформацією лише з офіційних сторінок органів влади.
Збережіть собі офіційні сторінки Національної поліції України та обласних управлінь поліції, аби оперативно отримувати правдиву інформацію.
Отримуйте інформацію тільки з офіційних сайтів

Офіс Президента України

Верховна Рада України

Кабінет Міністрів України

Служба безпеки України

Міністерство оборони України

Міністерство внутрішніх справ України

Генеральний штаб Збройних сил України

Державна прикордонна служба України

Кіберполіція

Національна поліція України